欢迎来到广音医疗科技有限公司官网
高尿酸血症与痛风
高尿酸血症是一种嘌呤代谢紊乱引起的代谢异常综合征。非同日2次血尿酸水平超过420μmol/L时可判定为高尿酸血症。
当血尿酸超过其在血液或组织液中的饱和度时会形成尿酸钠晶体并沉积在关节局部,这些尿酸钠晶体诱发关节局部炎症反应和组织破坏,即为痛风。
高尿酸血症是痛风的直接诱因,贯彻于痛风的四个病理生理阶段:
无症状高尿酸血症期(无症状高尿酸血症及无症状单钠尿酸盐晶体沉积)
急性痛风性关节炎期(关节炎突然发作时期,关节红肿热痛,疼痛剧烈)
痛风间歇期(两次急性痛风性关节炎发作之间的阶段)、
慢性痛风性关节炎期(关节持续疼痛,血尿酸水平持续波动,可伴有痛风石出现)。
国内外临床研究证据汇总,高尿酸血症还与代谢综合征、2型糖尿病、高血压、心血管疾病、慢性肾病、痛风密切相关,是这些疾病发生发展的独立危险因素。
高尿酸血症的流行趋势
根据卫健委最新印发的《成人高尿酸血症与痛风食养指南2024年版》数据显示,我国成人居民高尿酸血症患病率为14%,痛风患病率为0.86%~2.20%,男性高于女性,城市高于农村,沿海高于内陆。与痛风患者常为中老年男性的传统印象不同,年轻人已经成为高尿酸血症和痛风的主力军,近60%的高尿酸血症以及痛风问题的患者是18-35岁的年轻人。有研究显示,广州城区1600名高中学生高尿酸水平检出率超过50%[1]。近年来,高尿酸血症和痛风正在呈现高流行,年轻化的态势。
“一入一出”影响尿酸水平
痛风是一种多基因遗传病,其发生和发展受环境因素和遗传因素的共同作用,其中遗传因素起重要的作用。相比其他哺乳动物,人类在进化过程中丢失了尿酸氧化酶,缺乏对尿酸的进一步代谢途径,对高尿酸血症和痛风具有天然易感性。
尿酸生成过多和排泄不足两大因素同样影响着人体内尿酸水平。
一方面高尿酸血症的高发早发与现代人饮食习惯改变有着密切关系,随着生活水平的提高,高糖、酒精饮料及以动物肉类海鲜为代表的高嘌呤饮食的大量高频摄入与高尿酸血症发生密切相关。超量嘌呤摄入是导致尿酸盐合成过多的根本原因。
另一方面尿酸的排泄主要受到遗传因素与病理生理状态的影响。约90%的高尿酸血症和痛风是由尿酸排泄减少或重吸收增加引起的。尿酸排泄在肾脏和肾外(如肠道)中进行,肾脏排泄占尿酸排泄的70%,剩余的30% 则由肾外器官排泄。作为人体重要的尿酸排泄器官,肾脏中大部分尿酸的转运发生在近端肾小管中,其中约有90% 被肾小球过滤的尿酸会被重新吸收到血液中,剩下的10% 则会被排出体外(图一)[2]。
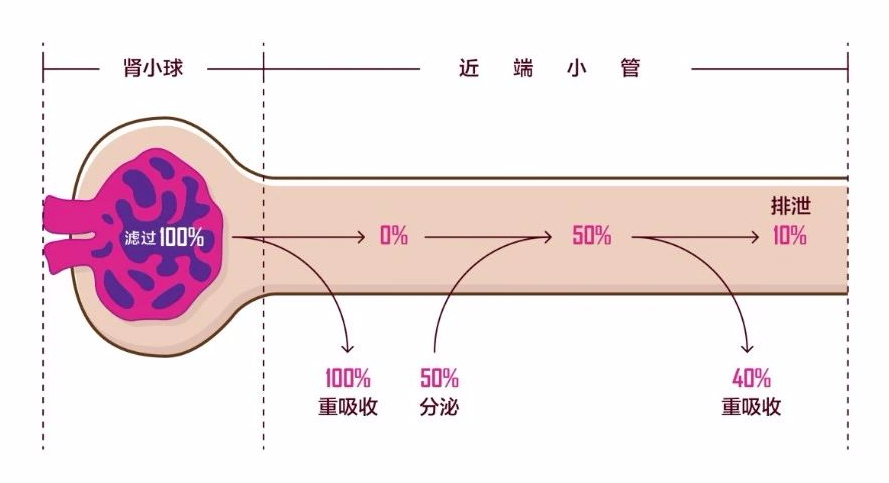
血清中尿酸的稳态是这种分泌作用与重吸收共同作用达到动态平衡的结果。尿酸定向转运的结构和物质基础依赖于近端肾小管在管腔侧(顶膜)和基底膜侧分布着的不同转运蛋白。最近《柳叶刀》上痛风综述对尿酸盐转运机制进行了阐释,基底膜上的转运蛋白OAT1(SLC22A6)、OAT2(SLC22A 7)和OAT3(SLC22 A8)将尿酸盐转运到近端肾小管细胞,转运蛋白ABCG2、ABCC4和NPT1(SLC17A1)介导尿酸盐向肾小管腔中进行分泌。被分泌到管腔中的尿酸盐通过细胞顶膜上的转运蛋白URAT1(SLC22A12)、OAT4(SLC22A11),OAT10(SLC22A13)和GLUT9(SLC2A9)转运重新进入肾小管细胞,然后通过GLUT9完成重吸收(图2)[3]。
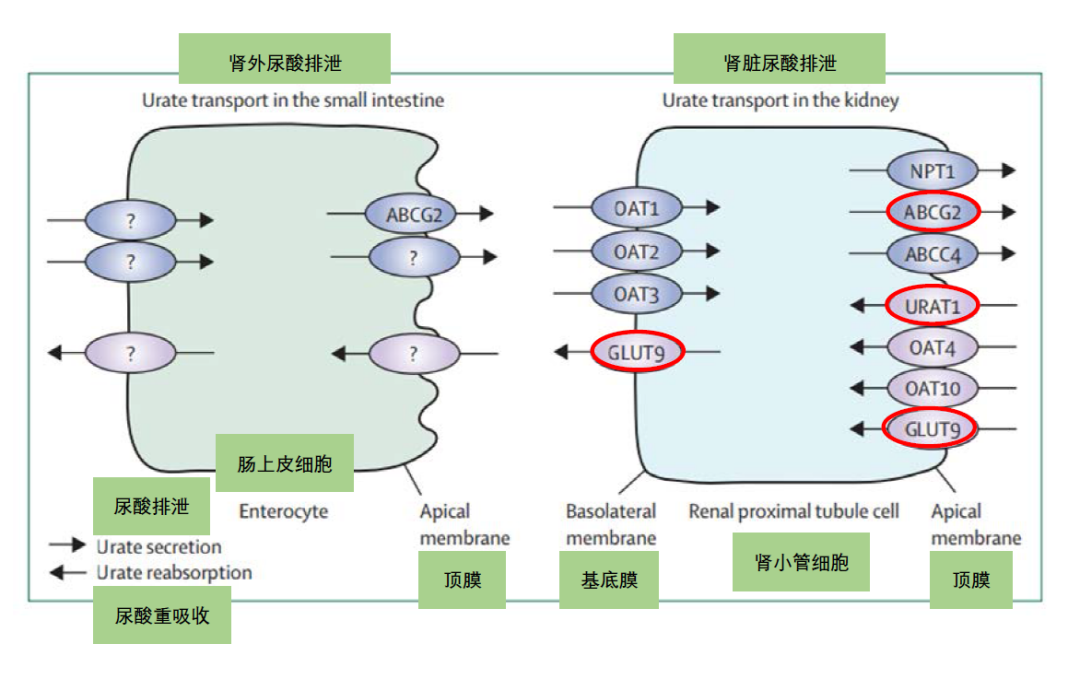
文中强调在这个过程中,尿酸分泌转运蛋白—ABCG2(ATP 结合转运蛋白G2);尿酸重吸收转运蛋白—GLUT9(葡萄糖转运蛋白9)和URAT1(尿酸转运蛋白1)起到的作用最为关键。由于基因具有多态性,编码该转运蛋白基因的突变会引起转运蛋白功能的变化,转运功能的改变会引这部分突变人群相对于一般人群的尿酸排泄不良,一旦叠加诱发高尿酸血症的环境因素,更易导致高尿酸血症或痛风。同时多项全基因组关联研究(GWAS)表明,高尿酸血症的发病与上述尿酸转运蛋白编码基因的多态性有着密切联系,是高尿酸血症发生的易感基因。
ABCG2—与尿酸排泄相关的易感基因
ABCG2基因编码ABCG2转运蛋白,其具有介导肾内以及肾外的尿酸排泄功能,若ABCG2转运功能降低则会发生肾尿酸分向外泌减少,最终导致肾超负荷型高尿酸血症[4]。rs2231142是ABCG2除野生型外最常见的遗传变异,也是研究最广泛的ABCG2 相关SNP。这种变异是一种错义突变,该突变使ABCG2出现严重的折叠和运输缺陷,约40%的ABCG2保存在内质网不能达到质膜,降解程度也较野生型增加,导致ABCG2在质膜的表达降低,尿酸盐转运率降低 53%。rs2231142与高尿酸血症与痛风的相关性在许多发表在权威期刊研究中得到广泛验证(PNAS[5],NG[6])。
关于中国人群痛风易感基因的最新研究是23年全基因组关联研究,该研究结果强调了该突变与痛风发生相关性[7]。A等位基因携带者尿酸水平更高,携带AA等位基因个体更易患痛风。同时对于早发痛风患者的研究也证实了这一点,早发型痛风多为痛风家族史者,表明痛风的发病年龄可能受遗传因素的影响。匈牙利人群中ABCG2携带A等位基因的患者出现痛风的时间比CC型痛风患者早8年,平均年龄为37.6岁,且痛风发作更频繁(≥2次/年)。由于该风险等位基因频率在亚洲人群中高达32%,远高于欧洲11%的突变频率,因此可以推测在亚洲人群中,该基因多态性和尿酸水平的相关性可能较其它基因更强。
SLC2A9和SLC22A—与尿酸重吸收相关的易感基因
SLC2A9和SLC22A分别编码GLUT9和URAT1转运蛋白。2002 年ENOMOTO 等首次发现大量URAT1 在肾皮质近曲小管上皮细胞管腔膜侧表达,并且检测出URAT1 具有在近曲小管内重吸收50% 左右尿酸的功能,因此URAT1也被认为是调节尿酸水平关键转运蛋白。临床利尿剂如丙磺舒、苯溴马隆、氯沙坦等可以通过作用于URAT1靶点降低尿酸的重吸收以促进尿酸排泄。在之后的研究中发现,在近曲小管的尿酸重吸收过程中GLUT9 同样发挥着不可忽视的作用,甚至可能比URAT1 的作用更为明显。GLUT9是尿酸、葡萄糖与果糖的转运蛋白。
该蛋白在肾小管具有尿酸重吸收功能,驱动重吸收的尿酸盐离子从肾小管上皮细胞依次进入组织间隙和小血管,回到体循环。在英国、克罗地亚和德国的人群样本研究中发现,SLC2A9基因多态性也与尿酸的低排泄分数有关。SLC2A9和SLC22A基因上的一些变异可影响SLC2A9蛋白对尿酸的重吸收,抑制肾脏对尿酸的排泄(肾脏排泄不良型),增加高尿酸血症和痛风发病风险。
高尿酸血症的药物治疗
患者主动到医院就诊原因大多由于痛风急性期的造成剧烈疼痛及导致的行动不便,医生通常首先给与非甾体抗炎药进行消炎止痛。在急性期症状缓解之后,治疗痛风的核心策略是以逆转高尿酸血症为目的的长期降低尿酸盐治疗,通过控制尿酸浓度从而使单钠尿酸盐晶体的溶解,并长期预防痛风发作。
别嘌醇作为指南首推的痛风治疗一线药物,是目前最为有效抑制尿酸合成的药物,临床应用广泛。尤其适用与肾超负荷型高尿酸血症患者。但该药可能引起非常严重的皮肤不良反应,如Stevens-Johnson综合征(SJS)、中毒性表皮坏死松解症(TEN)、剥脱性皮炎等,死亡率高达20%-40%。人类白细胞抗原(Human leukocyte antigens,HLA)是人类主要组织相容性复合体的表达产物,在免疫系统中主要负责细胞间的相互识别和诱导免疫反应,调节免疫应答。HLA-B *58:01已被多种指南认定为是别嘌醇严重皮肤反应(SCARs)的最大危险因素和特异性基因标志物。
在服用别嘌醇前先进行HLA-B *5801基因检测,可大大降低甚至避免别嘌醇引发的严重过敏反应。如HLA-B *58:01阳性就尽量避免使用别嘌醇,以提高用药的安全性。可以选用另一类尿酸合成抑制剂非布司他。而对于根据排泄分数确诊为肾排泄不良型患者,可进一步检测尿酸重吸收相关易感基因,如果确为转运体基因变异造成的重吸收功能异常,可优先选择苯溴马隆等重吸收抑制剂进行治疗。
参考文献:
[1] 邓鹭, 杜雪莹. 广州城区高中生血尿酸水平及影响因素分析 [J]. 中国学校卫生, 2019, 40(9): 3.
[2] MANDAL A K, MOUNT D B. The molecular physiology of uric acid homeostasis [J]. Annu Rev Physiol, 2015, 77: 323-45.
[3] DALBETH N, GOSLING A L, GAFFO A, et al. Gout [J]. Lancet, 2021, 397(10287): 1843-55.
[4] ICHIDA K, MATSUO H, TAKADA T, et al. Decreased extra-renal urate excretion is a common cause of hyperuricemia [J]. Nat Commun, 2012, 3: 764.
[5] WOODWARD O M, KöTTGEN A, CORESH J, et al. Identification of a urate transporter, ABCG2, with a common functional polymorphism causing gout [J]. Proc Natl Acad Sci U S A, 2009, 106(25): 10338-42.
[6] TIN A, MARTEN J, HALPERIN KUHNS V L, et al. Target genes, variants, tissues and transcriptional pathways influencing human serum urate levels [J]. Nat Genet, 2019, 51(10): 1459-74.
[7] CHANG Y S, LIN C Y, LIU T Y, et al. Polygenic risk score trend and new variants on chromosome 1 are associated with male gout in genome-wide association study [J]. Arthritis Res Ther, 2022, 24(1): 229.
2025年03月21日
2025年01月13日
2024年10月17日
2024年09月20日
2024年09月09日
2024年09月04日