欢迎来到广音医疗科技有限公司官网
首次支持降压治疗中基于CYP2D6基因型调整β受体阻滞剂的剂量
2024年7月CPIC(临床药物基因组学实施联盟) 发布了最新β受体阻滞剂个体化用药指南。β受体阻滞剂自20世纪60年代以来广泛用于防治心血管疾病,在高血压、冠心病、心力衰竭、心律失常及心肌病等的治疗中发挥着极其重要的作用,是治疗高血压的五大类药物之一。指南总结了最新临床研究成果,评估了β受体阻滞剂与其代谢酶、转运体及靶点基因(CYP2D6、ADRB1、ADRB2、ADRA2C、GRK4 、GRK5)作用后药物暴露和反应的关系。最终认为CYP2D6遗传多态性与美托洛尔暴露和心率反应之间关联的证据水平极高,可以根据CYP2D6代谢型给出指导美托洛尔临床处方的用药建议。

代谢酶
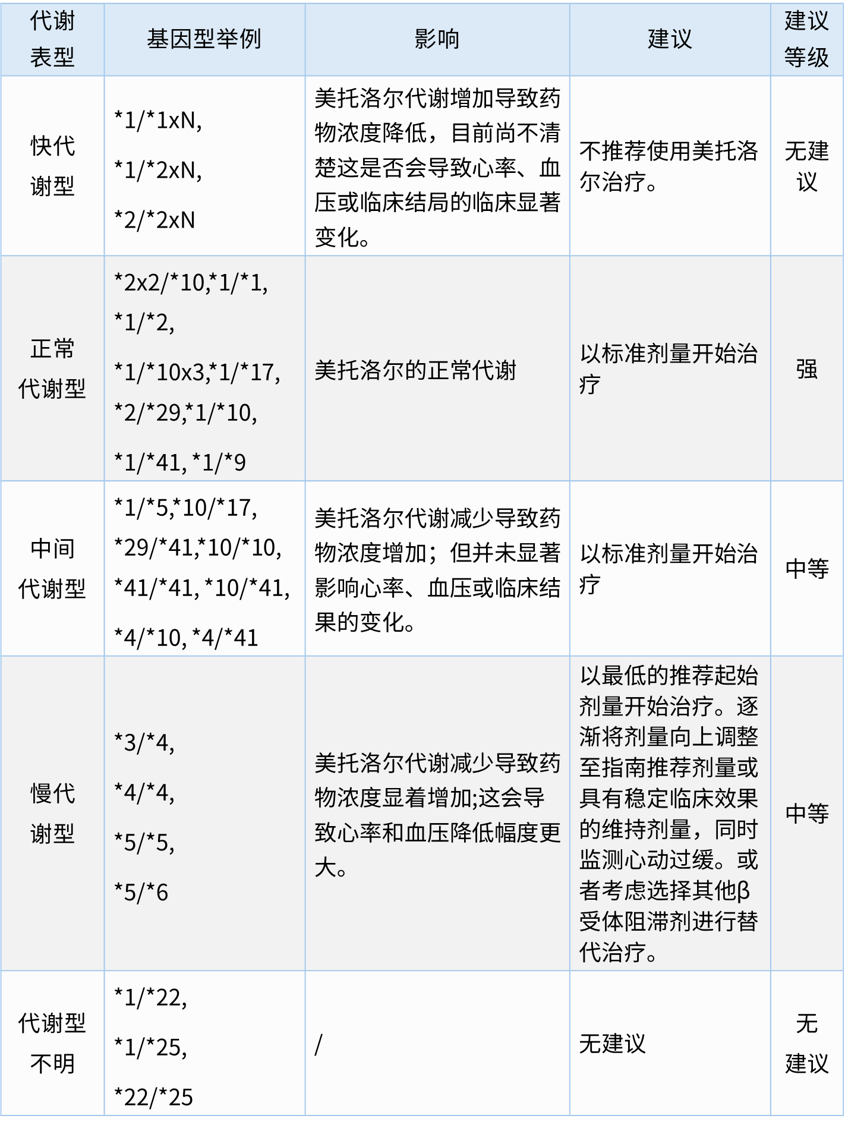
CYP2D6编码的代谢酶在β受体阻滞剂类药物的肝脏代谢和消除中起主要作用。有研究显示,不同代谢型患者使用美托洛尔、卡维地洛、奈比洛尔呈现出药代动力学差异。与非慢代谢型患者相比,CYP2D6慢代谢型患者在口服上述给药后血浆药浓度高出数倍。在一些研究中,携带不同基因型患者使用上述药物后表现出明显的药代动力学差异,但用药后的临床反应在不同研究中大多存在矛盾结论,仅有美托洛尔的研究一致证明了用药后的心率和血压反应差异与CYP2D6基因型相关。有证据表明,CYP2D6慢代谢者使用美托洛尔治疗暴露量显着增加,导致美托洛尔相关的血压(收缩压约3-6mmHg;舒张压2-6 mmHg)和心率(约3-8次/分钟)下降幅度更大,这种对美托洛尔的心率反应可能会增加患者心动过缓的不良反应风险。指南认为与以标准剂量作为美托洛尔起始剂量的方案相比,对慢代谢者采用低剂量作为起始剂量,然后根据患者用药后反应(心率和血压)逐渐增加剂量的用药方案,患者发生不良反应的风险更小。指南给出了基于CYP2D6基因多态性的美托洛尔用药建议,旨在最大限度地降低CYP2D6 慢代谢者使用美托洛尔后的不良反应风险。
基于CYP2D6 表型的美托洛尔用药建议
靶点与转运体
β受体阻滞剂分为两类,若主要拮抗位于心脏组织中的β-1 肾上腺素能受体,该药物则归类为β-1选择性或“心脏选择性”;如果它们同时拮抗β-1和β-2受体(主要位于平滑肌组织中,但也表达于心脏),则归类为“非选择性”。“非选择性”β受体阻滞包括卡维地洛、拉贝洛尔和普萘洛尔;“β-1选择性”药物包括阿替洛尔、倍他洛尔、比索洛尔、美托洛尔和奈比洛尔。
ADRB1 基因编码β-1肾上腺素能受体,该受体被“β1选择性”(例如美托洛尔、阿替洛尔)和“非选择性”(例如卡维地洛、拉贝洛尔、普萘洛尔)β受体阻滞剂拮抗。在ADRB1中,p.Ser49Gly和 p.Gly389Arg是研究最多的基因多态性。这两种变异导致β-1受体受到刺激后cAMP的产生减少,在一定程度上起到了与β受体阻滞剂相似的的作用。因此,理论上携带上述等位基因突变的患者对β受体阻滞剂表现出更强的药理学反应。然而,目前的证据并非一致性地支持携带这些突变的患者在使用β受体阻滞剂后,心率、血压相比一般人群存在明显差异。尤其是在心力衰竭(研究最多的患者群体)的研究中,ADRB1 多态性和使用β受体阻滞剂治疗患者的临床结果存在明显矛盾。同时研究者发现,几乎所有分析β受体阻滞剂剂量水平与使用药物后反应的研究中,都证明p.Gly389Arg与心血管结果之间有显著关联——当用低剂量β受体阻滞剂治疗时,p.389Arg/Arg基因型患者的预后明显差于其他基因型患者,但在较高剂量下未观察到类似的关联。鉴于目前已知的证据,指南编写委员会认为在更多的研究来进一步确认或反驳这一与剂量相关的观察结果之前,无法给出相关用药建议。
其他与β受体阻滞剂相关的靶点或转运体基因如ADRB2、ADRA2C、GRK4和GRK5的多态性与β受体阻滞剂反应相关的研究更少。因此,指南不提供基于ADRB2、ADRA2C、 GRK4或GRK5多态性的临床用药建议。
2025年03月21日
2025年01月13日
2024年10月17日
2024年09月20日
2024年09月09日
2024年09月04日