欢迎来到广音医疗科技有限公司官网
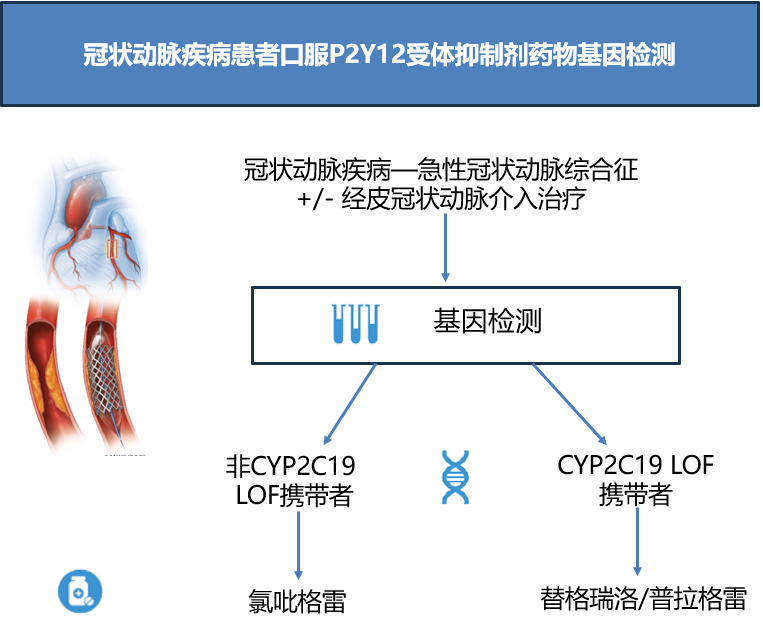
口服P2Y12抑制剂被广泛用于冠心病、卒中和外周动脉疾病患者的抗血小板治疗,但其疗效和安全性存在个体间显著差异。氯吡格雷是最常用的口服P2Y12抑制剂,作为一种前药,其主要经CYP2C19基因编码的细胞色素酶代谢为活性产物。而CYP2C19基因具有高度多态性,其中某些使其功能丧失的遗传变异在人群中非常常见,表现为活性代谢物水平降低和治疗中血小板聚集增加,从而导致氯吡格雷治疗时疗效降低缺血事件增加。CYP2C19基因检测可以识别这部分人群,当发现患者携带相关变异时,可以采用不依赖于CYP2C19激活的强效口服P2Y12抑制剂(如替格瑞洛或普拉格雷)进行替代疗法。但这些强效口服P2Y12抑制剂的使用也可能导致出血风险增加。声明总结了迄今为止的相关研究,指出基于基因检测的口服P2Y12抑制剂精准用药方案(为CYP2C19功能丧失的携带者开具替格瑞洛或普拉格雷,为非携带者开具氯吡格雷)可在减少缺血事件的同时不会增加出血风险。通过分析最新的临床研究与荟萃研究证据,声明认为在急性冠脉综合征或经皮冠状动脉介入治疗患者使用口服P2Y12抑制剂治疗前进行CYP2C19基因检测的诊疗方案在临床上具有高度可行性。
口服P2Y12抑制剂的药代动力学特征
遗传学角度
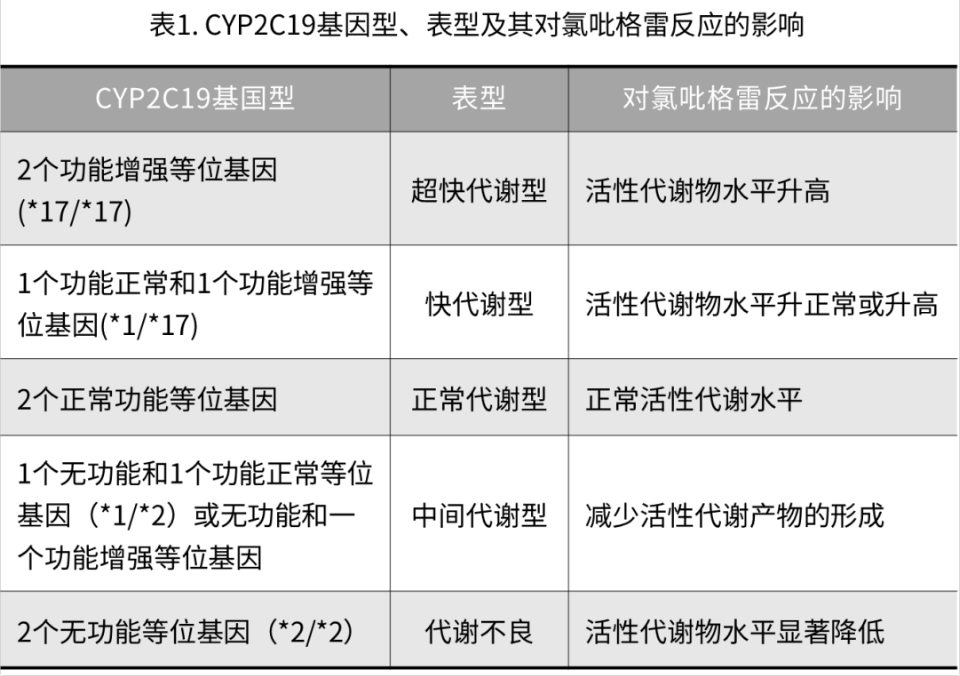
对健康受试者和冠心病患者接受氯吡格雷治疗的药代动力学研究表明,CYP2C19功能丧失(LOF)等位基因携带者活性产物生成减少。最常见的LOF等位基因包括CYP2C19*2(c.681G>A)和CYP2C19*3(c.636G>A)。在不同人种中,CYP2C19单倍型分布频率存在显著差异。如CYP2C19 *2单倍型在白人中的频率约为15%,在亚洲人群中为40%~50%。同样CYP2C19 *3单倍型在白人群体中罕见而在东亚人群中较为常见。尽管其他酶和转运蛋白基因也被发现与氯吡格雷的代谢和转运有关,但研究证实这些基因的变异对氯吡格雷的药代动力学产生的影响与预期不一致。因此现阶段证据仅支持CYP2C19等位基因组合及其预测的表型或代谢状态(表1)。相比之下,普拉格雷药代动力学未被证明受到遗传多态性的影响。虽然全基因组关联分析表明,SLCO1B1、CYP3A4和UGT2B7中的一些单核苷酸多态性(SNP)与替格瑞洛和替格瑞洛代谢产物水平显著相关。然而,这些SNP均与重大不良心脏事件(MACE)发生无关。
非遗传学角度
1.氯吡格雷
人口统计学因素,包括年龄、性别和体重,与氯吡格雷活性代谢产物水平的相关性很小。
奥美拉唑和埃索美拉唑抑制CYP2C19途径,会导致氯吡格雷活性代谢产物水平降低。
2.普拉格雷
普拉格雷的活性代谢产物浓度在老年患者和体重较低的患者中升高。黑框警告提示,建议体重<60公斤的患者使用较低的剂量(5毫克),通常不建议75岁以上的患者使用普拉格雷。
3.替格瑞洛
人口统计学因素对替格瑞洛的药代动力学影响较小,因此不需要根据这些因素调整剂量。
替格瑞洛主要受CYP3A通路相互作用的影响,使用替格瑞洛治疗应避免使用该通路的强抑制剂/诱导剂。
不同口服P2Y12抑制对血小板聚集的影响
高剂量氯吡格雷比标准剂量氯吡格雷更能降低血小板反应性;
普拉格雷和替格瑞洛是比高剂量氯吡格雷更有效的血小板抑制剂;
更有效的药物(普拉格雷和替格瑞洛)疗效可能伴随更高的出血风险;
唯—一项直接比较普拉格雷与替格瑞洛在CYP2C19 LOF携带者中的血小板抑制程度的研究表明,这两种药物之间没有差异。
CYP2C19基因检测对口服P2Y12抑制剂进行个体化治疗∶对冠心病和中风临床结局的影响
在LOF携带者中继续使用氯吡格雷会导致缺血事件增加;
与氯吡格雷相比,LOF携带者在接受替格瑞洛或普拉格雷治疗时缺血事件的发生率显著降低;
替格瑞洛/普拉格雷对缺血事件的有益作用在很大程度上取决于CYP2C19基因型;
与普遍使用氯吡格雷相比,基因指导治疗有利于降低缺血事件的风险,同时不会显著增加出血风险;
在主要不良心脏事件(MACE)和出血方面,CYP2C19基因指导治疗并不逊色于普遍使用替格瑞洛,且可显著减少出血风险。
基于血小板功能测试与基于基因指导下口服P2Y12抑制剂个体化治疗的比较
迄今为止,两种检测方法之间没有直接比较的研究证据。血小板功能检测的优势在于直接确定治疗中血小板反应性水平,血小板反应性高和低分别影响血栓和出血风险增加。然而,由于检测结果可能随时间发生变化,需要进行多次重复评估,并且患者需要用给定的抗血小板药物治疗一定时间(例如,用氯吡格雷治疗至少1-2周),以便能够充分确定其反应性(滞后性),因此其临床实施一直具有挑战性。
相比之下,通过基因检测可以在治疗前确定氯吡格雷抵抗的表型,一旦确定了CYP2C19 LOF携带者,即可使用替格瑞洛或普拉格雷等替代疗法治疗改善血小板抑制。而仅依赖基因检测的缺点是,CYP2C19基因型仅代表抗血小板药物反应的一个因素,并非所有CYP2C19 LOF携带者都降低了血小板抑制。因此,将遗传数据与ABCD-GENE(年龄、体重指数、慢性肾病、糖尿病和基因分型)评分等临床变量相结合可能会提高识别氯吡格雷反应不良患者的准确性。
CYP2C19基因检测︰临床考虑
分子病理学协会(Association for Molecular Pathology)推荐了CYP2C19等位基因分型组合,并将这些等位基因指定为1级。1级等位基因定义为具有以下特征:
1)该等位基因对CYP2C19活性及药物的影响已经被证明;
2)有较高的等位基因频率;
3)有可用的参考材料,包括CYP2C19*2、*3和*17等位基因。
一些研究人员和机构提倡采取先发制人的策略,即在药物暴露前,将对药物反应至关重要的变异体的药物遗传学信息存入患者的电子健康档案中,向临床医生提供预警信息提示。
保险报销与成本收益
截至2021年6月,美国医疗保险认为在特定情况下(例如,正在接受经皮冠状动脉介入治疗并开始或重新开始氯吡格雷治疗的急性冠状动脉综合征患者)进行CYP2C19基因检测在医学上具有必要性。在美国和其他国家许多使用决策分析模型分析同期临床事件率和医疗成本研究发现,相比普遍无差别使用替格瑞洛,在CYP2C19基因分型指导下ACS患者接受PCI的抗血小板治疗具有很高的成本效益。研究者利用模型对美国2020年退伍军人事务数据进行了成本效益分析,结论为与不进行基因检测直接使用替格瑞洛或普拉格雷相比,基于CYP2C19基因检测的方案被证明具有较高的质量调整生命年和较低的总体成本。其他几项研究也证明了CYP2C19基因分型指导下的急性卒中和高危短暂性脑缺血患者的抗血小板治疗具有成本收益。
临床实施中存在的挑战
1)缺乏临床指南和药物基因组学教育,尽管许多临床医生对药物遗传学检测及其临床意义持积极态度,但在其常规临床实践中采用药物遗传学检测的比例不到10%。
2)缺乏相关遗传顾问或有经验的药师为患者进行教育和提供结果解释。
3)临床应用的关键是临床医生如何快速获得基因检测结果。易于实施的快速即时检测可增加CYP2C19基因检测的采用率,是未来发展的方向。
4)基因检测结果通过先发制人的检测模式整合于个人的电子健康档案中,医生可以在用药干预前查阅相关遗传信息从而以此为依据做出合适的处方决定。缺点是成本、报销的不确定性,以及随着新的科研证据积累需要定期更新结果。
相关指南支持
在美国食品药品监督管理局(FDA)氯吡格雷药物标签信息的黑框警告中有关于慢代谢者使用氯吡格雷无效性的明确描述,并在其提供的最新药物遗传学协会声明中扩展到中间代谢者,建议为此类患者使用替代疗法。
2020年ESC发布的无持续性ST段抬高急性冠脉综合征管理指南,推荐在经过选择的非ST段抬高急性冠脉综合征患者中,根据CYP2C19基因型指导双联抗血小板药物降阶治疗。
2022临床药物遗传学实施联盟指南建议,对于CYP2C19中间代谢者和弱代谢者,在没有禁忌症的情况下,建议使用标准剂量的普拉格雷或替格瑞洛。因为有高质量数据支持,该建议等级为强推荐(1A)。
2025年03月21日
2025年01月13日
2024年10月17日
2024年09月20日
2024年09月09日
2024年09月04日